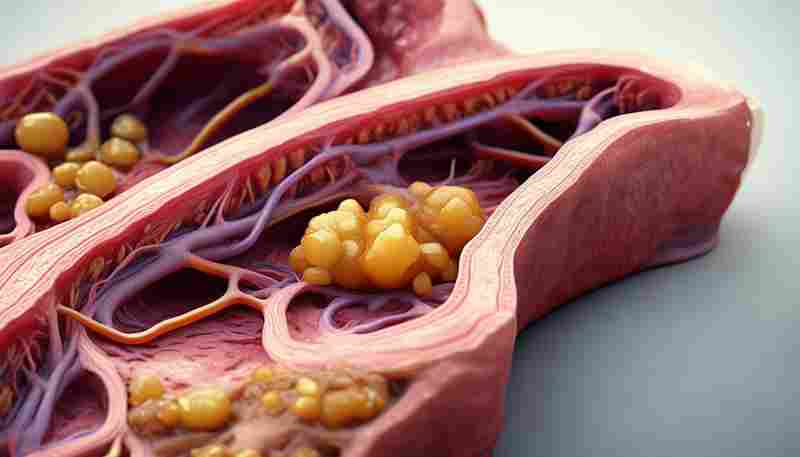
类风湿性关节炎与骨关节炎的病理机制区分
关节疾病中,类风湿性关节炎(RA)与骨关节炎(OA)常因相似症状被混淆,但两者的病理机制存在本质差异。RA以免疫系统异常激活为特征,导致全身性炎症及多器官受累;OA则以局部关节退行性病变为核心,与机械磨损和代谢失衡密切相关。理解二者的机制差异不仅有助于精准诊疗,也为探索靶向治疗提供方向。
发病机制差异
RA的病理基础源于免疫系统对自身组织的错误攻击。免疫紊乱触发T淋巴细胞异常活化,释放干扰素-γ等促炎因子,进而激活巨噬细胞和B细胞,形成抗环瓜氨酸肽抗体(ACPA)和类风湿因子(RF)等自身抗体。这些抗体通过补体系统激活,引发滑膜炎症及血管翳形成,最终导致软骨和骨质破坏。值得注意的是,RA的免疫反应具有系统性,可能累及肺、心脏等关节外器官。
OA的发病机制则聚焦于机械应力与代谢失衡的交互作用。软骨细胞在长期负荷下发生凋亡,基质金属蛋白酶(MMPs)过度分泌导致胶原降解,关节润滑功能丧失。肥胖、老龄化等因素通过激活固有免疫系统,促使滑膜巨噬细胞向促炎表型(M1)极化,加剧局部低度炎症。这种慢性炎症虽不如RA剧烈,但通过破坏软骨-骨稳态,最终形成骨赘和关节畸形。
病理特征对比
RA的典型病理标志是滑膜血管翳增生。活化的滑膜成纤维细胞(FLS)分泌血管内皮生长因子(VEGF),促进新生血管形成,这些血管结构紊乱的翳状组织富含炎症细胞,可直接侵蚀软骨下骨。组织学显示RA滑膜中淋巴细胞浸润密度显著高于OA,且浆细胞浸润比例高达76%,远超出OA的25%。
OA的病理进程始于软骨微结构损伤。电镜观察显示OA软骨表面出现原纤维形成,蛋白聚糖含量下降导致抗压能力减弱。随着病程进展,软骨下骨发生硬化反应,骨重塑异常形成骨赘,这种代偿性增生反而加剧关节力学失衡。值得注意的是,OA滑膜虽存在轻度炎症,但FLS增生程度仅为RA的1/3,且缺乏特异性自身抗体。
炎症调控差异
RA的炎症风暴由复杂细胞因子网络驱动。肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)形成正反馈环路,刺激滑膜细胞分泌基质金属蛋白酶(MMP-3、MMP-13),其浓度可达健康人群的10-20倍。JAK-STAT信号通路异常激活进一步放大炎症反应,导致不可逆的关节破坏。临床研究显示,RA患者血清IL-17水平与影像学进展速度呈正相关。
OA的炎症反应则呈现低烈度、慢性化特征。滑液检测发现IL-1β和TNF-α浓度仅为RA患者的1/5-1/3,但脂联素等抗炎因子分泌同时受损。补体系统在OA中呈现双重作用:C3a促进软骨细胞修复,而C5a却加速基质降解,这种平衡打破导致修复能力滞后于破坏进程。
遗传与环境影响
RA具有显著遗传倾向,HLA-DRB1共享表位(SE)等位基因携带者发病风险增加3-5倍。全基因组关联研究(GWAS)发现PTPN22基因多态性可改变T细胞受体信号阈值,导致自身反应性淋巴细胞逃逸胸腺阴性选择。环境因素中,吸烟通过瓜氨酸化蛋白修饰触发ACPA产生,这种表位扩展现象在RA前驱期即可检测。
OA的遗传风险更多涉及机械敏感基因。GWAS筛选出的GDF5基因变异影响关节形态发育,导致生物力学分布异常。肥胖作为独立危险因素,不仅增加关节负荷,脂肪组织分泌的瘦素还可直接激活软骨细胞内NF-κB通路,促进炎症介质释放。值得关注的是,关节创伤后发生的OA中,HMGB1蛋白通过TLR4信号诱发慢性炎症,形成创伤后OA的特殊亚型。
诊断与治疗分型
RA的诊断依赖于多维度评估。抗CCP抗体特异性达98%,较传统RF更能早期识别ACPA阳性亚型。滑膜活检显示,CD20+B细胞浸润与疾病活动度相关,指导生物制剂选择。治疗策略聚焦免疫调控,JAK抑制剂通过阻断γ链细胞因子信号,可同时抑制Th17分化和破骨细胞成熟。
OA的诊疗强调结构保护。MRI可早期发现软骨T2值延长,提示基质水合状态改变。药物治疗中,双醋瑞因通过抑制IL-1β转换酶发挥软骨保护作用,临床研究显示其可延缓关节间隙狭窄达0.15mm/年。近年研究揭示ANGPTL4蛋白在OA滑液中异常升高,针对其C端片段的单抗在动物模型中显示出软骨修复潜力。
上一篇:类比手法在议论文中如何增强说服力 下一篇:粗心与焦虑如何相互影响探索心理机制